Nauka stale zaskakuje. Szczególnie interesujące dziedziny, jak genetyka czy immunologia, odsłaniają coraz to nowe karty. Dla wielu, to właśnie te obszary nauki przynoszą najbardziej zdumiewające informacje. Nie inaczej jest w przypadku gościa specjalnego niniejszego artykułu – antygenu HLA-G.
Aby jednak zaczerpnąć wiedzy w obszarze antygenu HLA-G, należy w pierwszej kolejności rozpocząć od przestudiowania, czym jest główny układ zgodności tkankowej MHC (ang. major histocompatibility complex), ludzki HLA (ang. human leukocyte antigens). Układ ten uchodzi za jedno z najbardziej doniosłych odkryć immunologii. Co ciekawe, odkryty został przypadkiem, podczas badań dotyczących odrzucania przeszczepów skóry u myszy [1]. Wtedy to właśnie antygeny odpowiedzialne za odrzut przeszczepu allogenicznego (patrz przypis 1) nazwano antygenami zgodności tkankowej, natomiast układem zgodności tkankowej nazwano zespół kodujących je genów. Nazwa ta została wprowadzona jako miara szybkości odrzucania przeszczepu 70 lat temu przez George’a Davis’a Snell’a, który to właśnie zajmował się uwarunkowaniami genetycznymi odrzucania przeszczepów nowotworów u myszy [1]. Za badania nad głównym układem zgodności tkankowej Benacerraf, Dausset i Snell otrzymali w 1980 roku Nagrodę Nobla [14].
MHC kontra HLA. Co kryje się dokładnie pod tymi skrótami?
Główny układ zgodności tkankowej MHC występuje u kręgowców, natomiast ludzki układ zgodności tkankowej HLA jak sama nazwa wskazuje – u człowieka. Warto pamiętać o tych fundamentalnych różnicach. HLA jest kompleksem genów kodujących klasy cząsteczek MHC [14].
Cząsteczki MHC to glikoproteiny (patrz przypis 2), angażujące się w zainicjowanie odpowiedzi odpornościowej organizmu, odpowiadające za prezentację antygenów limfocytom T (patrz przypis 3) [1]. W literaturze rozróżnia się dwie lub trzy klasy cząsteczek MHC. Głównym wytłumaczeniem tych rozbieżności jest fakt, że cząsteczki klasy III nie wykazują podobieństwa do klasy I i klasy II. Nie są związane z procesem prezentacji antygenu. Stanowią bowiem różnorodną grupę cząsteczek uczestniczących w reakcjach zapalnych. Służą głównie jako sygnały do komunikacji międzykomórkowej. Ich przynależność do MHC jest w zasadzie kwestionowana, pomimo tego, że locus (patrz przypis 4) cząsteczek klasy III ma miejsce pomiędzy regionami kodującymi antygeny klasy I i II [13].
Przy udziale cząsteczek MHC, komórki układu odpornościowego mają możliwość odróżnienia komórek własnych, prawidłowo funkcjonujących, od komórek nieprawidłowych (np. zainfekowanych patogenami bądź ulegających transformacji nowotworowej) [1]. Cząsteczki klasy I występują na powierzchni wszystkich komórek jądrzastych organizmu. Cząsteczki klasy II znajdują się natomiast na komórkach dendrytycznych, limfocytach B, makrofagach. Możliwe jest również ich występowanie na komórkach nabłonkowych grasicy czy na komórkach nabłonka tarczycy [1].
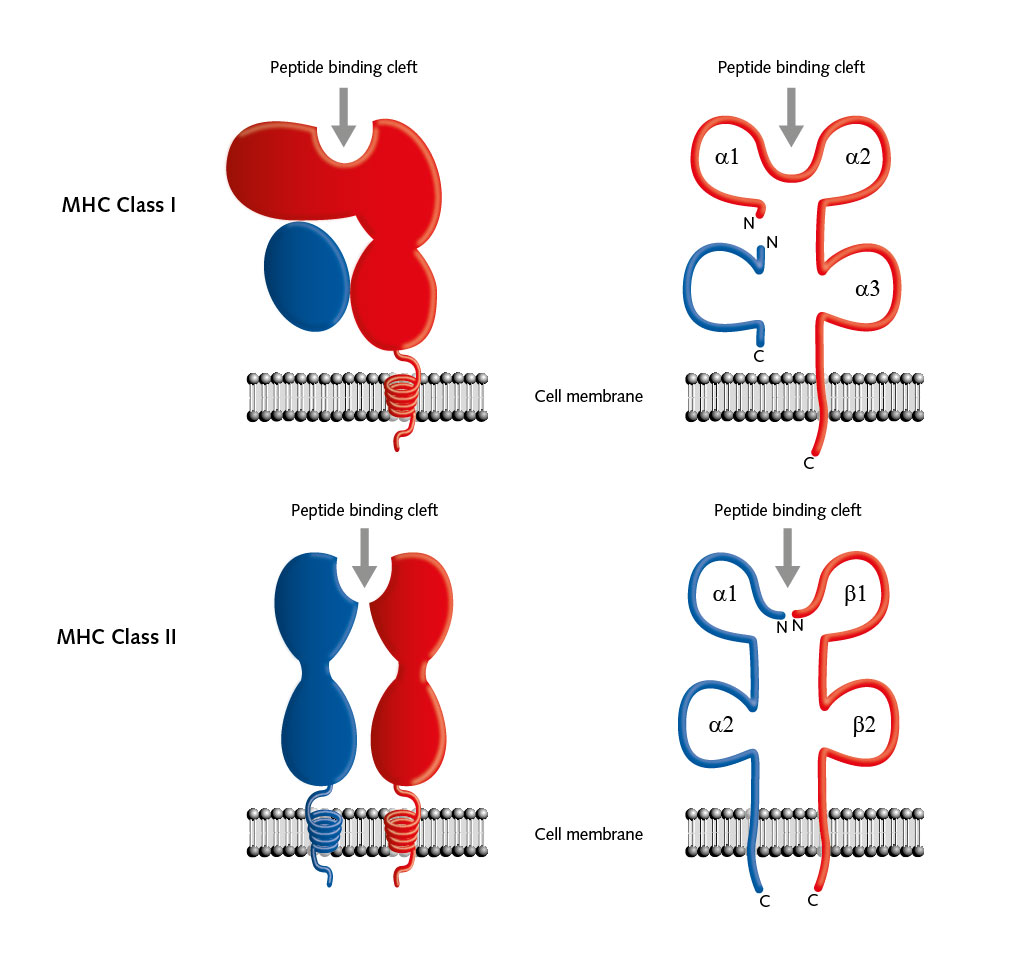
Ryc. 1: Budowa cząsteczek MHC
Źródło: https://promocell.com/cells-in-action/histocompatibility-piecing-together-the-immunotherapy-puzzle/
Układ immunologiczny ma za zadanie bronić organizm przed dwoma rodzajami czynników patogennych – endogennych oraz egzogennych. Cząsteczki MHC klasy I prezentują limfocytom Tc (patrz przypis 5) czynniki endogenne, do których zaliczane są wirusy, bakterie wewnątrzkomórkowe a także zmiany nowotworowe. Egzogenne natomiast są prezentowane limfocytom Th (patrz przypis 6) przez cząsteczki MHC klasy II. Ten rodzaj patogenów obejmuje te, które rozwijają się w płynach ciała i innych przestrzeniach pozakomórkowych, czyli bakterie zewnątrzkomórkowe, pasożyty, a także wydzielane przez nie toksyny [13].
Patogeny pochodzenia endogennego, są w cytoplazmie degradowane kolejno przez proteasomy (patrz przypis 7) i peptydazy (patrz przypis 8), by następnie zostać przetransportowanymi z cytozolu (patrz przypis 9) do retikulum endoplazmatycznego (ER) (patrz przypis 10) przy udziale białek TAP (patrz przypis 11). W ER, peptydy przetworzone przez proteazy retikularne zostają umieszczane na cząsteczkach MHC klasy I, a te z kolei, po przemieszczeniu się na powierzchnię komórki są skanowane przez Tc. Limfocyty Tc zabijają komórki, które prezentują peptydy pochodzące z nieprawidłowych białek wewnątrzkomórkowych [15].
Antygen zewnętrzny dostaje się do wnętrza komórki przez wgłębienie błony komórkowej, tworząc wczesny endosom (patrz przypis 12), zawierający enzymy proteolityczne – katepsynę D i katepsynę B (patrz przypis 13), które rozkładają antygen na prostsze fragmenty (peptydy). Wczesny endosom nie jest strukturą stabilną i w miarę upływu czasu ulega połączeniu z lizosomem (patrz przypis 14). Enzymy zawarte w lizosomach, syntetyzowane w aparacie Golgiego, powodują całkowitą degradację białka antygenowego i utratę jego immunogenności (patrz przypis 15) . Powstałe dwupeptydy i wolne aminokwasy są następnie transportowane do cytoplazmy, gdzie służą jako materiał budulcowy lub energetyczny [16].
Główny układ zgodności tkankowej człowieka – HLA nazwano w ten sposób bowiem pierwotnie wykryto go na białych krwinkach, stąd nazwa – leukocytarny. Obecnie wiadomo, że MHC obejmuje kompleks ściśle sprzężonych genów HLA, zlokalizowanych na szóstym chromosomie, na krótkim jego ramieniu (dokładnie w pozycji 6p21.1––6p21.3) i obejmuje przeszło 4 miliony par zasad, które tworzą ponad 100 genów [3]. Cechuje się dużym stopniem polimorfizmu (patrz przypis 16), nadzwyczajną różnorodnością jeżeli chodzi o możliwe konfiguracje i układy genetyczne występujące u ludzi [1]. Przyczyny utrzymywania się tych zmienności są od lat przedmiotem wielu badań biologów ewolucyjnych [14]. Cecha ta jest wynikiem selekcji naturalnej, zachodzącej na przykład pod presją czynników infekcyjnych, a co za tym idzie, chorób przez nie wywołanych. Można więc określić to w ten sposób, że choroby zakaźne to główny czynnik sprzyjający utrwalaniu danego polimorfizmu [1]. Sprowadza się to do tego, że poszczególne geny MHC występują w populacjach ludzkich w wielu wariantach. Odkryto od kilkuset do ponad tysiąca wariantów (alleli) w każdym locus.
W 1989 r., po raz pierwszy przeanalizowano i nazwano dużą liczbę alleli HLA. Od tego czasu, praca polegająca na utrzymywaniu tej bazy danych była sprawą najwyższej rangi. Rozpowszechnianie nowych nazw i sekwencji alleli ma ogromne znaczenie. Baza danych IPD-IMGT / HLA gromadzi dane odnośnie liczby alleli, które są fachowo analizowane i nadzorowane, zanim zostaną nazwane przez Komitet Nomenklatury WHO. Poniżej przedstawiono wykres obrazujący liczbę alleli nazwanych od roku 1987 do końca grudnia 2020 roku.
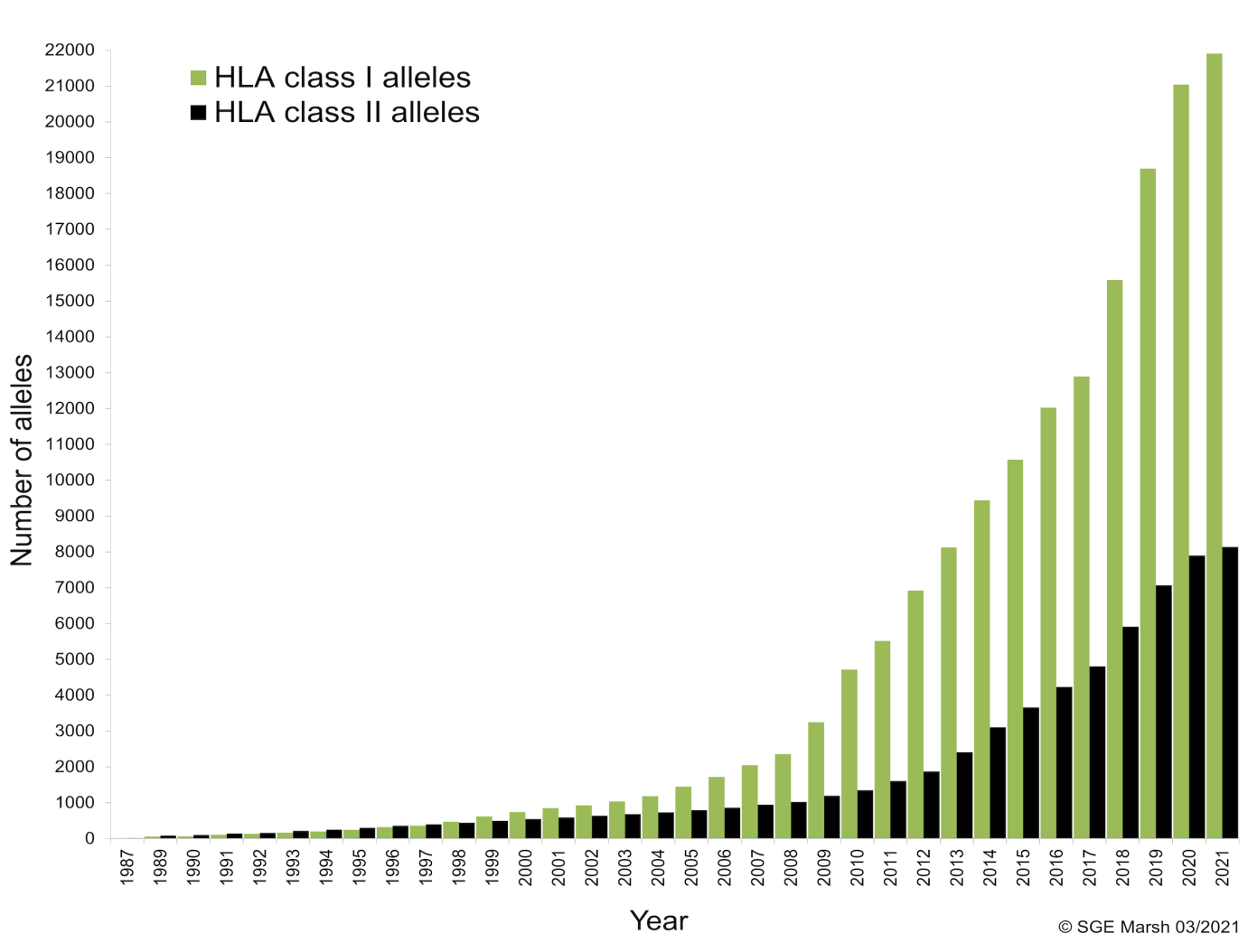
Wykres 1: Liczba alleli nazwanych w latach 1987-2021
Źródło: http://hla.alleles.org/nomenclature/index.html
Zmienność genów HLA, a tym samym kodowanych przez nie cząsteczek, ma ogromne konsekwencje medyczne nie tylko w transplantologii, mimo, że HLA jest kojarzony głównie jako antygeny transplantacyjne. Poszczególne warianty (allele) HLA związane są z odpornością na patogeny, np. HIV [4], i z występowaniem chorób autoimmunizacyjnych [23]. Układ ten jest uznawany za jeden z najbardziej istotnych elementów układu immunologicznego, bowiem pozwala na efektywne rozpoznawanie struktur antygenowych [2], a kluczową, biologiczną funkcją jego cząsteczek jest regulacja odpowiedzi immunologicznej [5].
Zadziwia fakt, że występowanie określonych wariantów HLA skorelowane jest ze zwiększonym ryzykiem pojawienia się niektórych chorób. Odpowiedź immunologiczna może przynieść odwrotny skutek, a posiadanie określonego allelu HLA jest w takim przypadku związane z wystąpieniem stanu patologicznego. Ma to związek na przykład z charakterystycznymi sekwencjami aminokwasów, nieprawidłowo sfałdowanymi białkami oraz z nieprawidłowo przetworzonymi peptydami antygenowymi. Z tym zjawiskiem wykazano powiązanie blisko 500 jednostek chorobowych. Są to między innymi: reumatoidalne zapalenie stawów i zesztywniające zapalenie stawów kręgosłupa, choroba Addisona, toczeń rumieniowaty układowy, stwardnienie rozsiane, zapalenie tarczycy Hashimoto, łuszczyca, cukrzyca typu I [1]. Naukowcy opracowali nawet ogólnodostępny katalog, który zawiera choroby związane z wariantami HLA (www.phewascatalog.org).
Antygeny ludzkiego układu zgodności tkankowej, jak wcześniej wspomniano, dzielą się na trzy główne podregiony: geny klasy I, II oraz III. Klasy I i II mają wspólne zadanie: prezentowanie peptydów na powierzchni komórki celem ich rozpoznania przez limfocyty T [6]. Jeżeli chodzi o klasę I, to prezentuje ona antygen limfocytom z markerem CD8 (patrz przypis 17), a klasa II limfocytom z markerem CD4 (patrz przypis 18) [17]. Geny, które kodują cząsteczki HLA klasy I, położone są dystalnie (najbliżej telomeru).Geny klasy II położone są proksymalnie (najbliżej centromeru). Region, który koduje cząsteczki klasy III znajduje się pomiędzy regionami kodującymi antygeny klasy I i II.
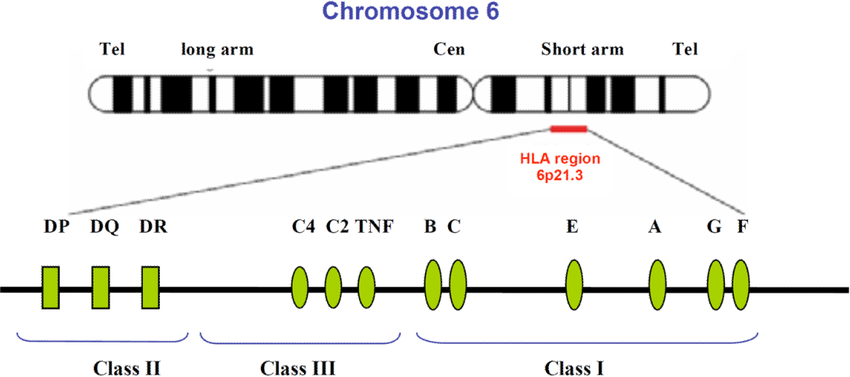
Ryc. 2: Region HLA na chromosomie 6
Źródło: https://www.researchgate.net/publication/26750144_HLA_Associations_with_Nasopharyngeal_Carcinoma
Najczęściej spotykany podział antygenów HLA na klasy zaprezentowano poniżej. Wyodrębnia się antygeny klasyczne oraz nieklasyczne – co to oznacza? Nieklasyczne mogą być kodowane poza regionem, wykazują niewielki polimorfizm bądź wcale. Klasyczne różnią się budową, wykazują ogromny polimorfizm, są istotne w transplantologii.
Region klasy I zawiera klasyczne geny HLA-A , HLA-B i HLA-C, które kodują łańcuchy ciężkie cząsteczek klasy I [5]. Ponadto w tym regionie istnieją inne, zwane HLA-E, HLA-L, HLA-J, HLA-K, HLA-H i HLA-G, które kodują nieklasyczne cząsteczki HLA [18]. Wyodrębnia się pięć głównych typów białka HLA klasy II oznaczonych jako HLA-DP, HLA-DQ,HLA-DR (klasyczne) oraz HLA-DM, HLA-DO (nieklasyczne). Aby sklasyfikować je w odpowiednich loci na chromosomie 6, stosuje się nomenklaturę składającą się z trzech liter: pierwsza (D) oznacza klasę, druga (M, O, P, Q lub R) rodzinę, a trzecia (A lub B) łańcuch (odpowiednio α lub β). Tymczasem w regionie klasy III zidentyfikowano ponad 50 genów. Wśród nich, interesujące są między innymi składowe dopełniacza C4, C2 (patrz przypis 19), białka uczestniczące w zapaleniu lub aktywacji komórek NK (ang. natural killer) (patrz przypis 20), białka szoku cieplnego – HSP (ang. heat shock proteins) (patrz przypis 21), rodzina TNF (ang. tumor necrosis factor) (patrz przypis 22) [4] [5].
Kiedy przeszczep ma prawo się udać?
Odpowiedzią na pytanie „Dlaczego znalezienie dawcy przeszczepu jest trudnym zadaniem?” jest, że przeszczepy od dawcy o niekompatybilnym typie antygenów zgodności tkankowej są odrzucane. Znaczenie w kwestii ewentualnego odrzucenia przeszczepu mają różnice genetyczne pomiędzy dawcą a biorcą w zakresie układu zgodności tkankowej. Układ odpornościowy biorcy może rozpoznać antygeny przeszczepu jako obce i wtedy uruchomić proces immunologiczny, który doprowadzi do zniszczenia przeszczepu, ponieważ antygeny HLA dawcy przeszczepionego narządu są zdolne wywołać niszczącą odpowiedź zapalną u biorcy [1]. Dobranie w pełni zgodnego w zakresie HLA dawcy jest podstawowym wymogiem skutecznej i bezpiecznej transplantacji. Mechanizm odrzucania przeszczepów powiązany jest z: rozpoznawaniem antygenów ujawnianych na komórkach dawcy, aktywacją limfocytów T biorcy (ich proliferacja i zdolność do cytotoksyczności), uszkodzeniem i niszczeniem przeszczepu [1]. Warto przy okazji poznać termin „typowania tkankowego”, którym określa się proces doboru odpowiedniego dawcy oraz biorcy. Kluczem do osiągnięcia najbardziej oczekiwanych wyników leczenia jest maksymalna zgodność tkankowa pomiędzy dawcą i biorcą, co oznacza identyczność antygenów zgodności tkankowej u dawcy i biorcy [13]. Często zgodnym dawcą okazuje się być rodzic, dziecko czy też rodzeństwo biorcy, z racji tego, że geny zgodności histologicznej są dziedziczone jako grupa, po jednym od każdego z rodziców. MHC jest dziedziczone w sposób mendlowski, z tym że dziedziczą się ściśle połączone loci tego układu, zwane haplotypami (patrz przypis 23). Każdy człowiek ma dwie grupy haplotypów (jeden od ojca, a drugi od matki). Ekspresji ulegają jednocześnie geny od obojga rodziców, więc występuje zjawisko kodominacji (patrz przypis 24) [4]. Haplotypy są zwykle dziedziczone w stanie nienaruszonym, a zatem antygeny kodowane przez różne loci są dziedziczone razem. Jednak zdarza się, że dochodzi do skrzyżowania dwóch chromosomów rodzicielskich, co skutkuje nową rekombinacją haplotypów [19][20].
Fenomen antygenu HLA – G
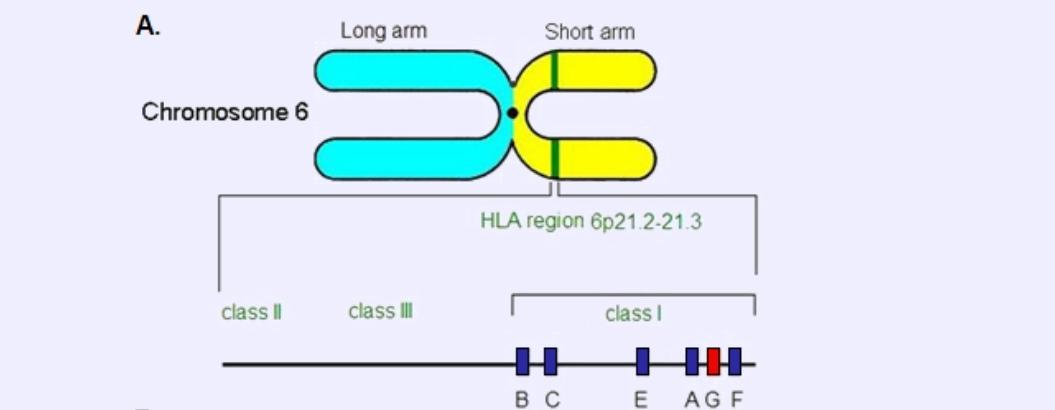
Lokalizacja genu HLA-G na podstawie http://atlasgeneticsoncology.org/Genes/GC_HLA-G.html
Ludzki antygen leukocytarny HLA-G, jest zlokalizowany pomiędzy genami HLA-A i HLA-F. Odgrywa niezwykle istotną rolę w stanach zarówno zdrowia jak i choroby, a działania z nim powiązane mogą mieć skutki pozytywne bądź negatywne – w zależności od sytuacji klinicznej. U kobiet będących w ciąży, w transplantologii czy w chorobach autoimmunologicznych, HLA-G ma korzystne znaczenie z racji wyciszenia reakcji immunologicznych. Jeżeli chodzi z kolei o choroby wirusowe oraz nowotworowe – umożliwia ucieczkę wirusa czy też komórek nowotworowych spod kontroli immunologicznej, unikając specyficznej odpowiedzi immunologicznej, co niekorzystnie wpływa na rokowania dla pacjenta. W tym wypadku, ta znaczna ekspresja może sprzyjać powstawaniu odległych przerzutów, a ocena jej ocena może być przydatna w prognozowaniu przebiegu choroby [2].
Cząsteczka HLA-G, poprzez interakcje z komórkami dendrytycznymi, może prowadzić do zmniejszenia ekspresji antygenów HLA klasy II na ich powierzchni oraz
zakłócać ich dojrzewanie. Ponadto, HLA-G, wywiera wpływ na produkcję cytokin przez komórki biorące udział w odpowiedzi immunologicznej. Wspomniane mechanizmy, wywołują stan immunosupresji co w konsekwencji prowadzi do wytworzenia tolerancji immunologicznej, czyli braku odpowiedzi immunologicznej na dany antygen [2].
Jednym z pierwszych mechanizmów wywoływania tolerancji immunologicznej, był układ pomiędzy matką-płodem [21]. Rola HLA-G została bowiem odkryta po raz pierwszy podczas badań nad jego ekspresją w komórkach trofoblastu (patrz przypis 26) w początkowym okresie ciąży. Tolerancja immunologiczna w ciąży, przejawia się brakiem odpowiedzi immunologicznej organizmu matki skierowanej przeciw obcym antygenowo tkankom płodu i łożyska. Ciąża jest szczególnym stanem gdyż podczas jej trwania,
układ immunologiczny kobiety musi się przystosować do tolerowania obcych antygenowo komórek. Rozwijający się w jamie macicy płód wykazuje ekspresję antygenów pochodzących zarówno od matki, jak i od ojca. Antygeny te są rozpoznawane przez komórki układu immunologicznego matki, ale w warunkach fizjologicznych, w prawidłowo przebiegającej ciąży, nie dochodzi do niszczenia komórek płodu. Przypuszczalnie, niewiele osób ma świadomość, że wiele niewyjaśnionych przypadków poronień ma podłoże autoimmunologiczne. Istnieje dość powszechne zjawisko odrzucenia ciąży przez organizm matki na skutek niezgodności immunologicznych [12]. Uważa się, iż HLA-G bierze udział w modulowaniu odpowiedzi immunologicznej w kwestii przebudowy naczyń krwionośnych podczas ciąży oraz w tłumieniu potencjalnych szkodliwych ataków immunologicznych wywoływanych przeciw płodowi [23].
HLA-G jest jednym z czynników wpływających na proces implantacji zapłodnionej komórki jajowej w błonie śluzowej macicy poprzez stymulowanie limfocytów
matki do produkcji cytokin umożliwiających zagnieżdżenie zarodka oraz dalszy prawidłowy rozwój płodu [2]. W warunkach fizjologicznych, HLA-G ochrania komórki płodu przed ich cytolizą, dzięki hamowaniu aktywności komórek NK a także limfocytów Tc obecnych w doczesnej (patrz przypis 27). Przypuszcza się, że HLA-G ma zdolność
prezentowania limfocytom T matki, endogennych antygenów wirusowych, by w ten sposób ułatwić eliminację wirusów na poziomie styku matczyno-płodowego [2]. Zmniejszoną ekspresję antygenu HLA-G wykazano w stanach zagrożenia ciąży, między innymi w stanie przedrzucawkowym (ang. preeclampsia) oraz w nawracających poronieniach, co potwierdza jego funkcję protekcyjną w ciąży [2]. W licznych badaniach dowiedziono, że we krwi
kobiety w ciąży, w płynie owodniowym oraz w łożysku dochodzi do zwiększonej ekspresji nieklasycznych antygenów HLA klasy I, w szczególności HLA-G. Rozpuszczalne izoformy HLA-G wykryto we wczesnym endometrium, dojrzałym kompleksie wzgórka jajnikowego, krwi matczynej kobiet w ciąży, we krwi pępowinowej, a także w osoczu nasienia. Formy te zaburzają funkcje i indukują usunięcie limfocytów T CD8+ skierowanych przeciwko antygenom pochodzenia ojcowskiego [2]. Ponieważ HLA-G ma istotne znaczenie dla przebiegu ciąży, to uważa się, że wszelkie zaburzenia ekspresji tego antygenu mogą skutkować jej niepowodzeniem. Nieprawidłowa ekspresja HLA-G na powierzchni cytotrofoblastu pozakosmkowego (patrz przypis 28) może być jedną z przyczyn rozwoju stanu przedrzucawkowego u kobiet w ciąży [2] [9]. Udowodniono, że niska ekspresja cząsteczek HLA-G1 i HLA-G5 jest czynnikiem ryzyka nawracających poronień, natomiast niska ekspresja sHLA-G2 wiąże się z ryzykiem niepowodzenia implantacji zarodka u kobiet poddanych procedurom zapłodnienia in vitro [2]. Obserwuje się stosunkowo niski poziom HLA-G u kobiet z cukrzycą ciążową w porównaniu z kobietami bez tego obciążenia, które to powoduje, że ciąża w takiej sytuacji jest powikłana [10].
Po zapłodnieniu, system odpornościowy matki powinien rozpoznać HLA ojca jako inny niżeli jej własny. Białe krwinki w macicy, powinny rozpocząć produkcję ochronnych przeciwciał, które mają funkcję ochronną przed komórkami NK matki. Jeśli dochodzi do sytuacji w której HLA rodziców są do siebie podobne, to komórki te mogą nie sprostać zadaniu i nie dokonać rozróżnienia, które jest niezbędne do produkcji kluczowych przeciwciał.
Dotychczas, ekspresję HLA-G opisano na powierzchni komórek skóry, mięśni, trzustki, dróg żółciowych i ośrodkowego układu nerwowego (OUN) [2]. Udowodniono związek między ekspresją HLA-G a występowaniem chorób skóry, przewodu pokarmowego, stawów, układu oddechowego czy też chorób demielinizacyjnych OUN. Cząsteczkę HLA-G znaleziono we fragmentach złuszczonego naskórka chorych na łuszczycę. Obniżone stężenie
HLA-G może mieć związek z rozwojem przewlekłej reakcji zapalnej w odpowiedzi na alergeny wziewne. HLA-G pojawia się w płynie mózgowo rdzeniowym chorych
na zapalenie opon mózgowo-rdzeniowych, w chorobie Alzheimera, w stwardnieniu rozsianym. Wzrost ekspresji HLA-G jest możliwy do zaobserwowania na powierzchni komórek nerwowych po zakażeniu wirusem wścieklizny [2].
Obserwuje się zmniejszoną ekspresję antygenu HLA-G1 i HLA-G5 w stanach zagrożenia ciąży, między innymi w stanie przedrzucawkowym, a także w nawracających poronieniach [11]. Jest to działanie protekcyjne [5].
Jak ukazano, główny układ zgodności tkankowej jest jednym z najbardziej istotnych elementów układu immunologicznego. Pozwala efektywnie rozpoznawać struktury antygenowe. Odgrywa istotną rolę w stanach zdrowia i choroby.
Przypisy
- Przeszczep między rożnymi genetycznie osobnikami tego samego gatunku
- Białka, które zawierają związane kowalencyjne, liczne oligosacharydy. Głównymi przedstawicielami są enzym, hormony białkowe, białka surowicy, wszystkie przeciwciała oraz substancje grupowe krwi,
- Limfocyty odpowiedzialne za komórkową odpowiedź odpornościową
- Określony obszar chromosomu zajmowany przez gen,
- Limfocyty cytotoksyczne, potrafią uśmiercić komórkę prezentującą antygen w kontekście MHC I. Rodzaj odporności komórkowej. Odgrywają zasadniczą rolę w odpowiedzi odpornościowej przeciwko patogenom wewnątrzkomórkowym,
- Limfocyty pomocnicze, pełniące funkcje związane z pobudzaniem odpowiedzi odpornościowej. Dojrzałe limfocyty Th noszą na swojej powierzchni cząsteczki CD4 i rozpoznają antygeny połączone z cząsteczkami MHC klasy II. Produkcją cytokiny, które mają zdolność modulowania odpowiedzi odpornościowej.
- Złożony kompleks białkowy, odpowiedzialny za degradację poliubikwitynowanego białka do małych peptydów,
- Enzymy mające na celu degradację białek na mniejsze fragmenty poprzez hydrolizę wiązań peptydowych
- Substancja półpłynna, która otacza organella w komórce,
- Błony biologiczne tworzące we wnętrzu komórki złożony system,
- Transporter związany z prezentacją antygenu,
- Organelle komórkowe, które odpowiadają za sortowanie materiału pobranego w drodze endocytozy,
- Grupa proteaz odporności wrodzonej, regulująca wnikanie wirusów do komórek gospodarza,
- Niewielkie pęcherzyki otoczone pojedynczą błoną białkowo-lipidową,
- Zdolność substancji do wywołania przeciwko sobie swoistej odpowiedzi odpornościowej,
- Jest to to najczęstszy rodzaj zmienności genetycznej wśród ludzi, reprezentujący różnicę w pojedynczym bloku budulcowym DNA, zwanym nukleotydem. To inaczej odmienne sekwencje DNA w poszczególnych, tych samych miejscach genomu,
- Rozpoznają i niszczą komórki zakażone wirusem lub zmienione nowotworowo.
- Pomagają rozpoznawać, atakować i niszczyć w sposób swoisty bakterie, grzyby i wirusy inne drobnoustroje, które zakażają organizm.
- Szereg białek, który pełni istotne funkcje w organizmie, utrzymując jego odporność oraz będąc uzupełnieniem roli przeciwciał. Klasyfikowany jest jako odporność nieswoista, gdyż nie potrafi samodzielnie rozpoznać obcych przeciwciał. Dopiero po pojawieniu się obcych antygenów dochodzi do aktywowania układu dopełniacza
- Stanowią podstawową populację komórek układu odpornościowego. Pełnią rolę niszczenia nieprawidłowych komórek: uszkodzonych, zainfekowanych przez wirusy lub wewnątrzkomórkowe patogeny.
- Ekspresja tych białek wzrasta, kiedy komórki są narażone na działanie czynników stresowych, m.in. podwyższonej temperatury,
- Czynnik martwicy nowotworów, grupa białek wydzielanych przez komórki układu odpornościowego, należących do cytokin. TNF wpływa na aktywność limfocytów oraz metabolizm innych komórek. Może działać przeciwnowotworowo,
- Grupa genów w organizmie, która została odziedziczona po jednym rodzicu,
- Zjawisko polegające na występowaniu dwóch alleli danego genu, z których żaden nie jest recesywny ani dominujący.
- Limfocyty, które mogą rozpoznawać autoantygeny,
- Występuje we wczesnym stadium rozwoju zarodka. To ochronna warstwa zewnętrznych komórek błony płodowej odpowiedzialna za tworzenie łóżyska jak również za transport substancji odżywczych,
- Przerosła i rozpulchniona błona śluzowa macicy. Rozrost następuje głównie pod wpływem progesteronu w trakcie cyklu miesiączkowego i ma na celu przygotowanie podścieliska dla zagnieżdżenia się zapłodnionej komórki jajowej. W razie zapłodnienia komórki jajowej błona śluzowa macicy ulega dalszym zmianom, przekształcając się w doczesną ciążową,
- Warstwa trofoblastu, która różnicuje się we wczesnym stadium rozwojowym zarodka, odpowiedzialna za tworzenie się łożyska oraz transportowane przez nie substancje odżywcze.
Bibliografia:
1. J. Gołąb, M. Jakóbisiak, W. Lasek, T. Stokłosa, Immunologia, PWN, Warszawa 2014, 51-56,272-280.
2. G. Klimkiewicz-Wojciechowska, E. Lech-Marańda, Rola ludzkiego antygenu leukocytarnego G w procesach immunologicznych i jego znaczenie kliniczne, Hematologia 2012, tom 3, nr 4, 327–342.
3.M. L. Kowalski, Immunologia kliniczna, Mediton, Łódź 2000, 33–48.
4. K. Wiktorowicz, K. Kaszkowiak, Budowa i funkcja ludzkich antygenów zgodności tkankowej, Część 1. Kodowanie i budowa, Forum Reumatologiczne 2018, tom 4, nr 1, 37–44
5. Yonsei Med J. The HLA System: Genetics, Immunology, Clinical Testing, and Clinical Implications, 48 (1): 20 lutego 2007 r.
6. M. Wieczorek, E. T. Abualrous,J. Sticht, M. Álvaro-Benito, S. Stolzenberg, F. Noé, Ch. Freund, Major Histocompatibility Complex (MHC) Class I and MHC Class II Proteins: Conformational Plasticity in Antigen Presentation, Front Immunol. 17.03.2017; 8: 292.
7. Tumer, B. Simpson, T. K. Roberts, Genetics, Human Major Histocompatibility Complex (MHC) 2020 September 2.
8. J. Nowak, The role of HLA disparity in hematopoietic stem cells transplantation, Hematologia 2010, tom 1, nr 1, 49–58.
9. E. Mosaferi, J. Majidi, B. Baradaran, HLA-G expression pattern: reliable assessment for pregnancy outcome prediction, Adv Pharm Bull, 2013 Dec;3(2): 443-446.
10. S. Shobeiri, S. Abediankenari, B. Lashtoo-Aghaee, Z. Rahmani, B. Esmaeili-Gorji, Evaluation of soluble Human leukocyte antigen-G in peripheral Blood of pregnant women with gestational diabetes mellitus, Caspian J Intern Med., 2016; 7(3): 178-182
11. O. Sipak-Szmigiel, C. Cybulski, E. Ronin-Walknowska, J. Lubuski, Ryzyko wczesnej ciąży w zależności od alleli HLA-G. Roczniki Pomorskiej AM w Szczecinie 2008; 54: 60–64.
12. N. Rouas-Freiss, P. Moreau, J. LeMaoult, B. Papp, D. Tronik-Le Roux, E. D Carosella Role of the HLA-G immune checkpoint molecule in pregnancy, Human Immunology
May 2021, Pages 353-361
13. Piotr Kuśnierczyk, Antygeny głównego kompleksu zgodności tkankowej. Budowa, genetyka i funkcja biologiczna, KOSMOS 1992, 41 (4): 34 9 -3 6 9.
14. Jacek Radwan, Ewolucja zmienności genów głównego kompleksu zgodności tkankowej, NAUKA 4/2012,155-162.
15. K. Wiktorowicz, K. Kaszkowiak, Budowa i funkcja ludzkich antygenów zgodności tkankowej, Część 2. Funkcja antygenów zgodności tkankowej, Forum Reumatologiczne 2018, tom 4, nr 2, 87–94.
16. W. Ptak, Mechanizmy prezentacji i rozpoznawania antygenu, KOSMOS 1992, 41 (4): 325-339.
17. E. Musiej-Nowakowska, Przydatność typowania HLA w rozpoznawaniu i prognozowaniu reumatoidalnego zapalenia stawów, Borgis – Nowa Medycyna 12/1999.
18. Goldsby RA, Kindt TJ, Osborne BA, Kuby J. Immunology. 5th ed. Mc Graw Hill; 2003. s. 171–94
19. Abbas AK, Lichtman AH, Pillai S. Cellular and Molecular Immunology. 7th ed. 2012. Immunologia komórkowa i molekularna; pp. 117–38.
20. Shiina T, Hosomichi K, Inoko H, Kulski JK. Mapa genomowych loci HLA: ekspresja, interakcja, różnorodność i choroba. J Hum Genet. 2009; 54 : 15–39.
21. L. Pączek, B. Foroncewicz, Tolerancja immunologiczna – wiodącym problemem transplantologii XXI wieku, Postępy Nauk Medycznych 1-2/2003, s. 40-44
22. K. Wiktorowicz, K. Kaszkowiak, Budowa i funkcja ludzkich antygenów zgodności tkankowej, Część 3. Rola antygenów MHC w chorobach reumatycznych, Forum Reumatologiczne 2019, tom 5, nr 1, 33–42.
23. S. Djurisic, T. Vauvert F. Hviid, HLA class Ib molecules and immune cells in pregnancy and preeclampsia, Front. Immunol., 23 December 2014.
24. F. Colucci, The role of KIR and HLA interactions in pregnancy complications, Immunogenetics 69, 557–565 (2017)







