Od wielu lat zewsząd docierają do nas informacje o nowych terapiach genowych, mających pomóc pacjentom z nieuleczalnymi dotąd chorobami. Jednak mało kto zdaje sobie sprawę w jaki sposób one właściwie działają i czy faktycznie są złotym Graalem medycyny.
Zacznijmy od początku. Geny są kodowane przez DNA. Są swego rodzaju instrukcją, jak zbudować białka kształtujące nasz organizm. Czasami coś pójdzie nie tak i dochodzi do powstania wariantu w kodzie genetycznym – mutacji (1). Większość wariantów genetycznych jest bez znaczenia, każdy z nas ma miliony takich zmian. Jednak w części przypadków taki wariant może być patogenny, co oznacza, że będzie upośledzać funkcję kodowanego białka. Jeśli do takiej mutacji dojdzie w czasie naszego życia (nazywamy to mutacją somatyczną), może to zapoczątkować kaskadę zdarzeń, prowadzącą ostatecznie do rozwoju nowotworu. Inne mutacje są nam przekazywane od rodziców wraz komórką jajową i plemnikiem – są to tak zwane mutacje germinalne. Ze względu na pojawienie się na bardzo wczesnym etapie rozwoju, takie warianty są obecne w każdej komórce naszego organizmu. To właśnie mutacje germinalne są najczęstszą przyczyną chorób genetycznych.
Choroby genetyczne to ogromna i niezwykle różnorodna grupa. Postępowanie z nimi jest bardzo trudne i właściwie w większości przypadków mówimy o łagodzeniu objawów, a nie o wyleczeniu. Jednakże dla części z nich pojawiło się światełko w tunelu. Jest nim możliwość zastosowania terapii genowych, celujących w przyczynę choroby, czyli w konkretną mutację.
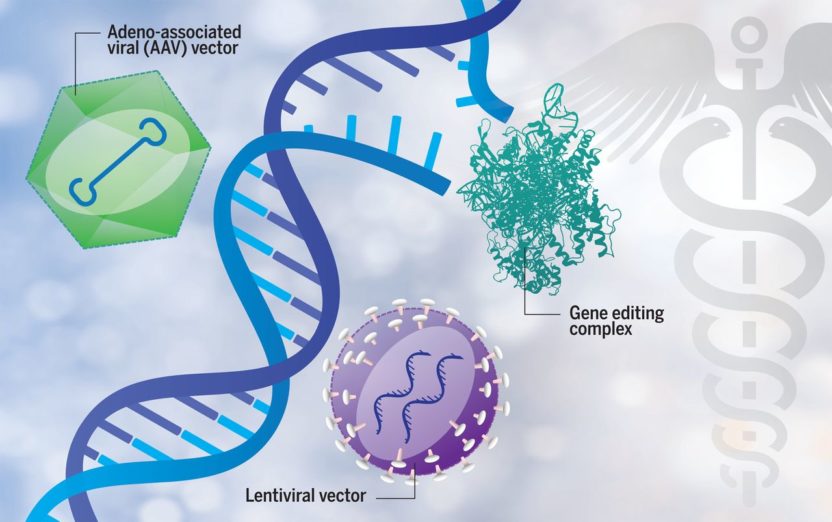
Terapia genowa polega na wprowadzeniu materiału genetycznego do komórki, co docelowo ma pozwolić na skompensowanie niefunkcjonalnego genu. Oznacza to, że jeśli uszkodzony gen nie jest w stanie doprowadzić do powstania działającego białka, wówczas wprowadzana jest prawidłowa kopia genu, która przejmuje jego funkcje i na jej podstawie produkowane jest w pełni sprawne białko. Oczywiście, zwyczajne wstrzyknięcie genu do komórki nie będzie działać i dlatego wymagane jest wykorzystanie specjalnego nośnika- wektora. W tym celu wykorzystuje się zmodyfikowane metodami inżynierii genetycznej wirusy: rozbrojone i niewywołujące choroby. Takie wirusy wprowadzają DNA z potrzebnym genem do jądra komórkowego, czyli centrum dowodzenia każdej komórki. Wprowadzone DNA może być na stałe wbudowane w nasz genom (do tego celu wykorzystujemy retrowirusy) lub przebywać tam jedynie przez określony czas (wtedy użyjemy adenowirusów). Do samego procesu transferu genów może dojść bezpośrednio w organizmie pacjenta (np. poprzez wstrzyknięcie zawiesiny wektora w tkankę lub bezpośrednio do krwiobiegu) albo w warunkach in vitro: komórki pacjenta są pobrane, następnie modyfikowane w laboratorium z użyciem wektorów wirusowych i z powrotem podane pacjentowi.
Alternatywną metodą jest edycja genomu, czyli wykorzystanie narzędzi biologii molekularnej do zmiany pojedynczych nukleotydów (literek tworzących DNA). Od kilku lat naukowcy i lekarze wiążą ogromne nadzieje z tą technologią. Narzędzia takie jak CRISPR/Cas9 (2) pozwalają na bardzo precyzyjną modyfikację genu np. w celu usunięcia mutacji albo wręcz przeciwnie, w celu zupełnego wyłączenia uszkodzonego genu. To ostatnie działanie może okazać się bardzo skuteczne w leczeniu chorób nowotworowych, gdzie częstą przyczyną jest nadaktywny gen, który wyrwał się spod kontroli komórki.
O metodzie CRISPR/Cas9 było bardzo głośno w 2018 roku, kiedy to na jaw wyszły nielegalne eksperymenty chińskiego naukowca He Jiankui. Ich celem było wyłączenie obu kopii genu CCR5 u dwóch dziewczynek, Nany i Lulu. W efekcie miały one zyskać odporność na zarażenie wirusem HIV. Badania częściowo się powiodły – u jednej z nich udało się z dużym prawdopodobieństwem osiągnąć cel, natomiast u drugiej wyłączona została tylko jedna kopia genu. Mimo częściowego sukcesu, ze względu na ograniczenia techniczne metody edycji genomu, nie można wykluczyć, że w genomach dziewczynek doszło do innych, nieplanowanych zmian. Nie można mieć również pewności, że zostały zmienione wszystkie komórki organizmu – mogło dojść do tak zwanego mozaicyzmu (3). Co więcej, nie wiemy jaki długofalowy wpływ na zdrowie człowieka będzie mieć tak inwazyjne działanie na ludzkim genomie. He Jiankui dostał zakaz wykonywania zawodu, dodatkowo skazano go na 3 lata więzienia i zapłatę 3 mln yuanów (1,7 mln zł) kary.
Poza powyższym niechlubnym wyjątkiem, obecnie na świecie prowadzone są tysiące badań związanych z opracowaniem nowych terapii genowych. Na tę chwilę, do pełnej rejestracji udało się doprowadzić tylko kilka-kilkanaście z nich. 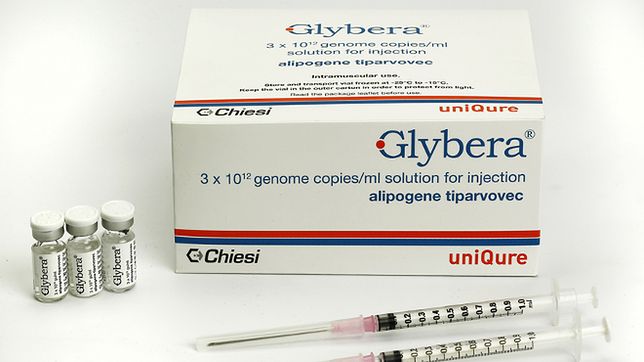 Pierwszym krajem, gdzie została oficjalnie zarejestrowana terapia genowa, były Chiny z lekiem Gendicine w 2003 roku. Lek wprowadzał za pomocą adenowirusowego wektora kopię genu TP53 – genu bardzo często uszkodzonego w chorobach nowotworowych. Mimo wielu lat od wprowadzenia Gendicine na rynek, nadal brak obiektywnych danych o skuteczności tego leku. W Europie pierwszą zarejestrowaną terapią przez Europejską Agencję Leków (ang. EMA) była Glybera w 2012 roku. Terapia została opracowana dla chorych na rodzinny niedobór lipazy lipoproteinowej, stanowiącej bardzo rzadką chorobę genetyczną. Po sześciu latach, z powodu bankructwa uniQure, firmy produkującej Glyberę, terapia ta została wycofana ze stosowania na terenie UE. Do tego czasu leczeniu poddało się 31 osób. Obserwacja pacjentów po około 5 latach od zakończenia terapii wykazała, że częstość i intensywność nawrotów choroby została zredukowana o około 50%, lecz terapia nie doprowadziła do całkowitego wyleczenia. Pierwszą terapią genową opartą na wektorze wirusowym zarejestrowaną na terenie Stanów Zjednoczonych przez Agencja Żywności i Leków (FDA) była Luxturna.
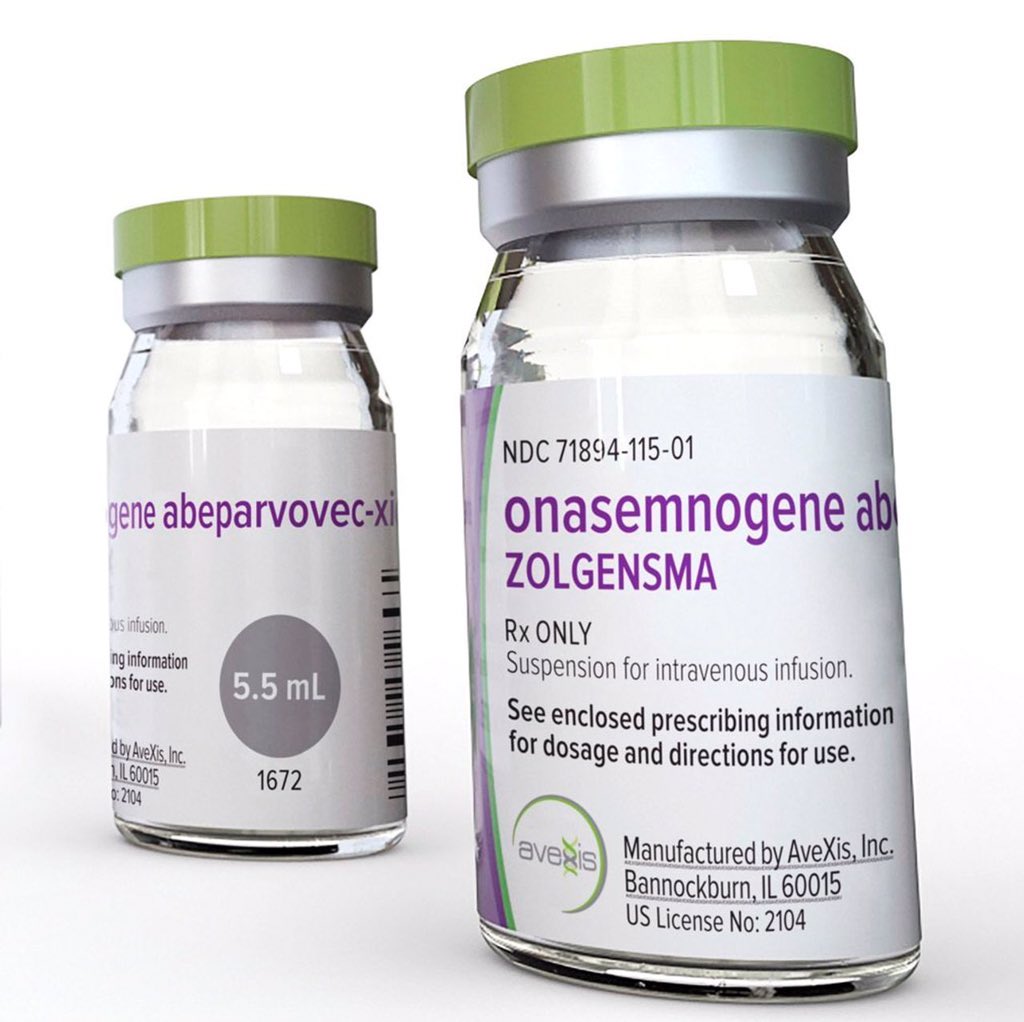
Pierwszym krajem, gdzie została oficjalnie zarejestrowana terapia genowa, były Chiny z lekiem Gendicine w 2003 roku. Lek wprowadzał za pomocą adenowirusowego wektora kopię genu TP53 – genu bardzo często uszkodzonego w chorobach nowotworowych. Mimo wielu lat od wprowadzenia Gendicine na rynek, nadal brak obiektywnych danych o skuteczności tego leku. W Europie pierwszą zarejestrowaną terapią przez Europejską Agencję Leków (ang. EMA) była Glybera w 2012 roku. Terapia została opracowana dla chorych na rodzinny niedobór lipazy lipoproteinowej, stanowiącej bardzo rzadką chorobę genetyczną. Po sześciu latach, z powodu bankructwa uniQure, firmy produkującej Glyberę, terapia ta została wycofana ze stosowania na terenie UE. Do tego czasu leczeniu poddało się 31 osób. Obserwacja pacjentów po około 5 latach od zakończenia terapii wykazała, że częstość i intensywność nawrotów choroby została zredukowana o około 50%, lecz terapia nie doprowadziła do całkowitego wyleczenia. Pierwszą terapią genową opartą na wektorze wirusowym zarejestrowaną na terenie Stanów Zjednoczonych przez Agencja Żywności i Leków (FDA) była Luxturna.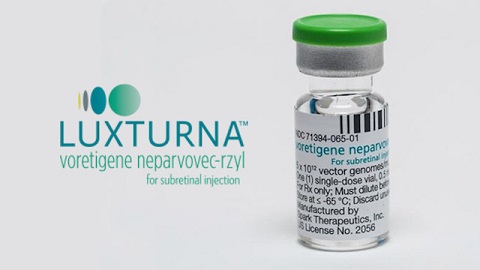 Luxturna, opracowana przez Spark Therapeutics, jest terapią dla pacjentów cierpiących z powodu dystrofii siatkówki wywołanej mutacją genu RPE65. Jej zastosowanie powoduje nie tylko zatrzymanie progresji choroby, ale także poprawę ostrości wzroku, która utrzymuje się w czasie dotychczasowej 4–letniej obserwacji. Niemniej, poprawa widzenia jest tylko częściowa. Kolejną zarejestrowaną terapią genową jest Zolgensma na rdzeniowy zanik mięśni (SMA), opracowana przez firmę AveXis (należącą do giganta farmaceutycznego Novartis). Terapia ta zasłynęła mianem najdroższej terapii na świecie (jednorazowa dawka kosztuje około 9 mln zł). Wyniki prób klinicznych 3 fazy (STR1VE, SPR1NT) zaprezentowane w marcu 2019 wykazują bardzo dużą skuteczność tej terapii, szczególnie w przypadku bardzo wczesnego zastosowania (<2 miesiąca życia). Niestety, nadal nie wiemy czy efekt terapeutyczny będzie długotrwały – do tej pory, żadne z dzieci po terapii Zolgensmą nie skończyło jeszcze dwóch lat. Ze względu na abstrakcyjnie wysoką cenę, niewiele osób jest w stanie pozwolić sobie na taką terapię. W tym roku AveXis ogłosiło kontrowersyjną loterię – darmową terapię dla setki dzieci z rozpoznanym SMA. By wziąć udział w losowaniu, szpital, w którym leczy się dane dziecko, musi wysłać zgłoszenie. Do tej pory, żaden polski szpital nie zdecydował się na wzięcie udziału w tym przedsięwzięciu. Loteria wzbudziła ogromną dyskusję w środowisku lekarskim, głównie skupioną na pytaniu czy decyzja kto otrzyma terapię może opierać się na ślepym trafie, a nie na popartej medycznymi dowodami analizie stanu zdrowia i potencjalnych korzyści dla danego pacjenta.
Luxturna, opracowana przez Spark Therapeutics, jest terapią dla pacjentów cierpiących z powodu dystrofii siatkówki wywołanej mutacją genu RPE65. Jej zastosowanie powoduje nie tylko zatrzymanie progresji choroby, ale także poprawę ostrości wzroku, która utrzymuje się w czasie dotychczasowej 4–letniej obserwacji. Niemniej, poprawa widzenia jest tylko częściowa. Kolejną zarejestrowaną terapią genową jest Zolgensma na rdzeniowy zanik mięśni (SMA), opracowana przez firmę AveXis (należącą do giganta farmaceutycznego Novartis). Terapia ta zasłynęła mianem najdroższej terapii na świecie (jednorazowa dawka kosztuje około 9 mln zł). Wyniki prób klinicznych 3 fazy (STR1VE, SPR1NT) zaprezentowane w marcu 2019 wykazują bardzo dużą skuteczność tej terapii, szczególnie w przypadku bardzo wczesnego zastosowania (<2 miesiąca życia). Niestety, nadal nie wiemy czy efekt terapeutyczny będzie długotrwały – do tej pory, żadne z dzieci po terapii Zolgensmą nie skończyło jeszcze dwóch lat. Ze względu na abstrakcyjnie wysoką cenę, niewiele osób jest w stanie pozwolić sobie na taką terapię. W tym roku AveXis ogłosiło kontrowersyjną loterię – darmową terapię dla setki dzieci z rozpoznanym SMA. By wziąć udział w losowaniu, szpital, w którym leczy się dane dziecko, musi wysłać zgłoszenie. Do tej pory, żaden polski szpital nie zdecydował się na wzięcie udziału w tym przedsięwzięciu. Loteria wzbudziła ogromną dyskusję w środowisku lekarskim, głównie skupioną na pytaniu czy decyzja kto otrzyma terapię może opierać się na ślepym trafie, a nie na popartej medycznymi dowodami analizie stanu zdrowia i potencjalnych korzyści dla danego pacjenta.
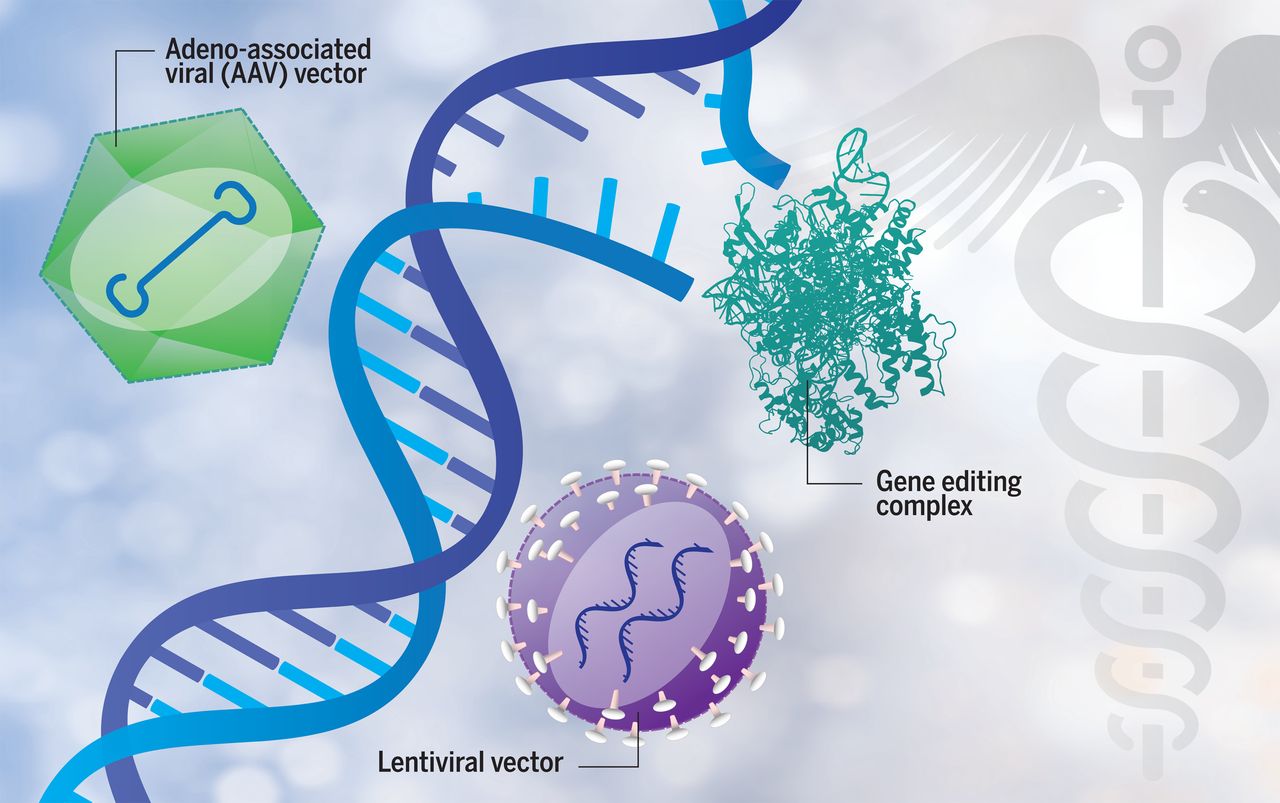
Rysunek 1 Dunbar, C. E. et al. Gene therapy comes of age. Science 359, (2018).
Drugą grupą terapii genowych są terapie polegające na pobraniu komórek od pacjenta, ich modyfikacji i wprowadzeniu z powrotem do organizmu. Przykładem może być Zynteglo, terapia leczenia choroby krwi – -talasemii (4), zatwierdzona w UE w 2019. Zakłada ona pobrania od pacjenta hematopoetycznych komórek macierzystych odpowiedzialnych za wytwarzanie czerwonych krwinek. Po pobraniu, komórki są modyfikowane za pomocą wektora wirusowego, tak, by posiadały dodatkową, funkcjonalną kopię genu HBB, głównego winowajcy wystąpienia -talasemii. W tym czasie pacjent jest poddawany intensywnej chemioterapii niszczącej wszystkie pozostałe w organizmie komórki hematopoetyczne. W kolejnym etapie, zmodyfikowane komórki z prawidłowym genem są podawane w postaci kroplówki i następnie zasiedlają one szpik kostny. Wyniki prób klinicznych, wskazują, że u ponad 50% pacjentów poddanych tej terapii, można było zrezygnować z obowiązkowych, częstych transfuzji krwi, albo znacznie je ograniczyć. Innym interesującym przykładem jest terapia Yescarta, wymierzona przeciwko nawracającym chłoniakom B-komórkowym. Yescarta została dopuszczona do stosowania na terenie US w 2017, a w UE w 2018 roku. Jest to terapia wykorzystująca CAR-T (5) czyli modyfikowane limfocyty typu T, pobrane od pacjenta. Po podaniu ich z powrotem do organizmu, zaczynają one „śledzić” i niszczyć komórki nowotworowe. Obecnie trwa wiele prób klinicznych badających przydatność tego podejścia w leczeniu innych nowotworów.
Dlaczego terapie genowe, mimo istnienia całego wachlarza technik, nie stały się do tej pory standardem w leczeniu pacjentów z chorobami genetycznymi i nowotworowymi? Po pierwsze, nadal pozostaje wiele niewiadomych na temat ich faktycznej skuteczności. W większości przypadków minęło zbyt mało czasu, by móc z pewnością stwierdzić, że dana terapia odniosła skutek i osiągnięty efekt będzie trwały. Po drugie, ze względu na indywidualne podejście do każdego pacjenta są one niezwykle drogie. W ich przypadku nie możemy mówić o podaniu tabletki, która wprowadzi oczekiwaną zmianę, a raczej o zaawansowanej terapii szytej na miarę, wymagającej zaangażowania wielu specjalistów różnych dziedzin i świetnie wyposażonych laboratoriów badawczych. Osobną kwestią jest bezpieczeństwo pacjenta. Modyfikowanie genomu rodzi ryzyko spowodowania zmian w miejscach zupełnie innych niż interesujący nas gen. Dodatkowo, nadal istnieją liczne problemy natury technicznej m.in. jak precyzyjnie doprowadzić wektor do docelowego typu komórek (modyfikacja innych może wywołać wiele problemów, a przecież nasz organizm składa się z bardzo wielu różnych typów komórek) albo jak sprawić by układ immunologiczny nie uznał dostarczonego materiału genetycznego za infekcję wirusową i nie zaczął go niszczyć.
Mimo powyższych trudności i problemów, terapie genowe wydają się być niezwykle obiecującym narzędziem, które z pewnością odniesie ogromną rolę już w niedalekiej przyszłości. Myślę, że przełom w tej dziedzinie nastąpi w ciągu najbliższej dekady, kiedy to doświadczenie zdobyte przy opracowywaniu obecnie dostępnych terapii, w połączeniu z wynikami długofalowych badań klinicznych oraz rozwojem technik inżynierii genetycznej pozwolą na rozwiązanie istniejących problemów.
Przypisy:
- Wariant genetyczny – zmiana w sekwencji nukleotydowej. Może być patogenny, łagodny i o nieokreślonym znaczeniu. Termin wariant genetyczny stopniowo zastępuje synonimiczny termin „mutacja”.
- CRISPR/Cas9 – narzędzi biologii molekularnej, bazujące na naturalnym, bakteryjnym systemie obronnym przed wirusami. Pozwala na precyzyjną modyfikację genomu.
- Mozaicyzm – występowanie dwóch linii komórkowych o różnym genotypie u jednego osobnika, który powstał z jednej zapłodnionej komórki jajowej.
- -talasemia (niedokrwistość tarczowatokrwinkowa) choroba krwi prowadząca do ilościowego zaburzenia syntezy hemoglobiny, spowodowana wrodzonym defektem biosyntezy łańcuchów globiny.
- CAR-T – chimeryczny receptor antygenowy CAR (ang. chimeric antygen receptor) czyli modyfikowane limfocyty typu T poprzez wprowadzenie do nich sztucznego receptora. Dzięki temu znacznie łatwiej wykrywają komórki nowotworowe i następnie je niszczą. Co więcej, modyfikowane CAR-T po wykryciu komórki nowotworowej zaczynają się dzielić, działając przez to jeszcze efektywniej.
Materiały dodatkowe:
– Ashmore-Harris, C. & Fruhwirth, G. O. The clinical potential of gene editing as a tool to engineer cell-based therapeutics. Clin Transl Med 9, 15 (2020).
– Dunbar, C. E. et al. Gene therapy comes of age. Science 359, (2018).
– Keeler, A. M., ElMallah, M. K. & Flotte, T. R. Gene Therapy 2017: Progress and Future Directions. Clin Transl Sci 10, 242–248 (2017).
– Baig, A. M. Human Genome-Edited Babies: First Responder with Concerns Regarding Possible Neurological Deficits! ACS Chem Neurosci 10, 39–41 (2019).