Choroby genetyczne to ogromna i bardzo różnorodna grupa jednostek chorobowych wywołanych przez nieprawidłowości w materiale genetycznym. Przyczyną mogą być zmiany związane ze strukturą i liczbą chromosomów, jak i zmiany w samych genach. W przypadku zaburzeń chromosomalnych poza leczeniem objawowym, właściwie nie istnieją opcje terapeutyczne celujące w przyczynę choroby. Natomiast, jeśli chodzi o zmiany w pojedynczych genach, perspektywa wygląda znacznie lepiej. Powoli naukowcom i lekarzom udaje się tworzyć coraz to lepsze terapie genowe wykorzystujące zdobycze biologii molekularnej. Metody te polegają na wprowadzeniu kopii prawidłowego genu do organizmu np. za pomocą nośników wirusowych lub poprzez edycję genomu. Ta ostatnia technika to w dużym uproszczeniu użycie biologicznej gumki do zmazywania, pozwalającej wymazać błędną literę i w jej miejsce wstawić prawidłową. W teorii brzmi to świetnie, niestety jak to często w życiu bywa, z praktyką jest znacznie gorzej. Terapie genowe są w większości nadal mało efektywne i ich stosowanie wiąże się z wieloma trudnościami. Dodatkowo, są one niezwykle kosztowne: na przykład jednorazowa dawka leku na rdzeniowy zanik mięśni, Zolgensma, kosztuje ok. 9 mln złotych – jest to obecnie najdroższy, do tej pory zarejestrowany lek, przez amerykańską Agencję Żywności i Leków (FDA). Innym przykładem jest Luxturna – terapia genowa stosowana w przypadku zwyrodnienia barwnikowego siatkówki. Pojedyncza dawka leku kosztuje około miliona złotych, a osiągany skutek terapeutyczny jest tylko częściowy. W efekcie, mimo tysięcy badań prowadzonych w najlepszych ośrodkach na całym świecie, do praktyki klinicznej wprowadzono jedynie kilka zarejestrowanych terapii.
Czy mamy jakąś alternatywę? A gdyby tak zamiast wymieniać gen na prawidłowy, zmusić go do prawidłowego działania, pomimo zaistniałych wad? O dziwo, takie podejście jest możliwe w przypadku niektórych defektów w genach. Dotyczy ono tak zwanych mutacji wprowadzających przedwczesne kodony STOP (inna nazwa to mutacje nonsensowne). Nie obędzie się jednak bez niezbędnego wprowadzenia naukowego (do pominięcia dla osób z podstawową wiedzą na temat biologii molekularnej).
Dla uproszczenia możemy założyć, że geny są swego rodzaju instrukcją zapisaną czteroliterowym kodem (A, T, G, C). To właśnie według tej instrukcji, w skomplikowanych procesach transkrypcji i translacji, budowany jest łańcuch aminokwasowy, który finalnie staje się białkiem. Każdy aminokwas jest kodowany przez zestaw trzech liter, tak zwany kodon sensowny. Istnieją również kodony niekodujące żadnego aminokwasu, oznaczające początek i koniec– są to kodony START i STOP. O ile występuje tylko jeden kodon START (oznaczany w kodzie jako ATG), tak kodonów STOP mamy aż trzy: TAA, TAG, TGA. Maszyną odpowiedzialną za odczytywanie genów i budowanie na ich podstawie łańcucha aminokwasowego jest rybosom wraz z całą masą towarzyszących mu kompleksów białek pomocniczych.
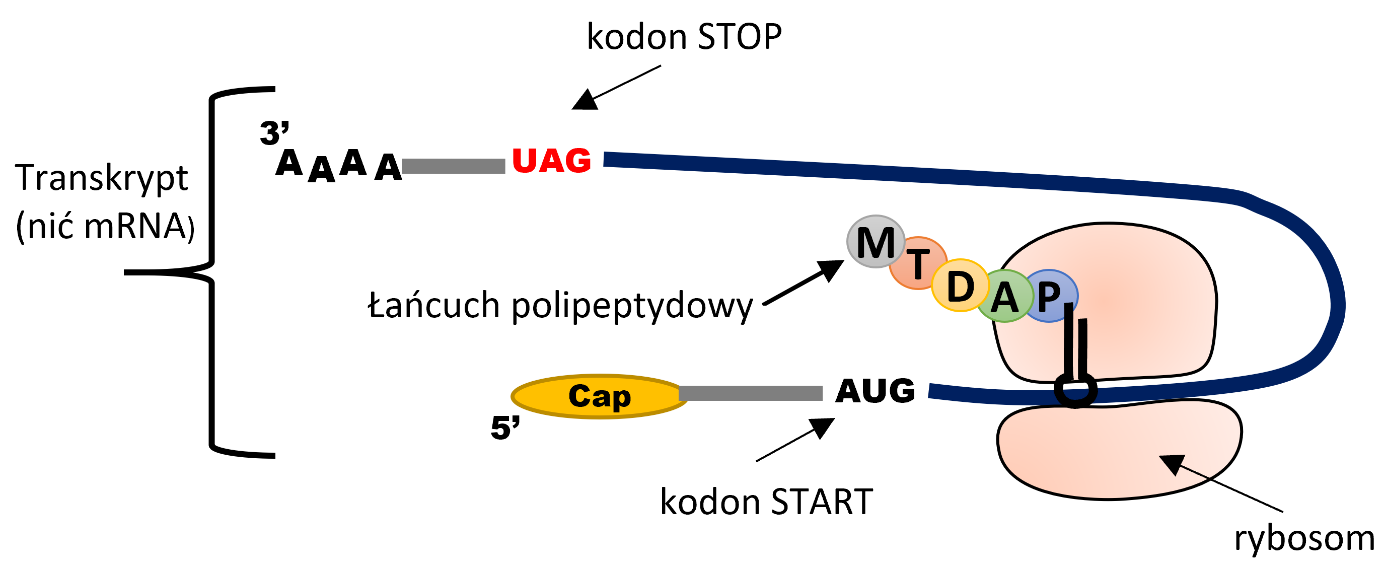
Rycina 1. Schemat przedstawiający aparat translacyjny (rybosom) w czasie procesu translacji.
Przyczyną wielu chorób genetycznych jest proces mutacyjny, który prowadzi do punktowej zmiany w jednym genie np. zmiany C na T. W efekcie zamiast aminokwasu glutaminy (kodowanego przez kodon CGA) powstaje kodon STOP (TGA). Prowadzi to do przerwania translacji przed właściwym miejscem zakończenia i powstania upośledzonego, skróconego białka. Takie białko nie może prawidłowo pełnić swojej funkcji, co skutkuje zapoczątkowaniem procesu chorobowego. Do najbardziej znanych chorób, których częstą przyczyną jest obecność przedwczesnych kodonów STOP należy m.in mukowiscydoza, dystrofia mięśniowa Duchenna oraz pierwotna dyskineza rzęsek (która poza objawami ze strony układu oddechowego może prowadzić do Zespołu Kartagenera – odwrócenia trzewi, czyli np. do umiejscowienia serca po prawej, a wątroby po lewej stronie klatki piersiowej). Leczenie tych chorób jest bardzo trudne i w najlepszym wypadku prowadzi jedynie do zahamowania progresji choroby lub złagodzenia objawów.
I tutaj z nieoczekiwaną pomocą przychodzą znane od dziesiątek lat antybiotyki z grupy aminoglikozydów. Antybiotyki aminoglikozydowe są powszechnie wykorzystywane do leczenie zakażeń bakteriami Gram ujemnymi. Mechanizm ich działania powoduje rozregulowanie procesu translacji mikroorganizmów i w następstwie ich śmierć. Do połowy lat 80’ XX wieku uważano, że ze względu na różnice w genomie, organizm ludzki jest niewrażliwy na działania aminoglikozydów. Jednakże, eksperymenty na liniach komórkowych pokazały, że ludzki aparat translacyjny również odczuwa skutki działania tej grupy leków. W przypadku bakterii, aminoglikozydy wiążą się do rybosomu powodując zmianę jego struktury trójwymiarowej, co prowadzi do powstania licznych błędów w produkowanym białku, jak i zignorowania istniejących kodonów STOP. W komórkach ludzkich, wiązanie się aminoglikozydu jest znacznie słabsze. Jedynym efektem jest mniej rygorystyczne przestrzenia znaków STOP. Zjawisko to początkowo wydaje się być niepożądane, lecz jest ogromną szansą dla osób z chorobami genetycznymi wywołanymi obecnością przedwczesnych kodonów STOP.
W czasie translacji genu zawierającego przedwczesny kodon STOP ludzki rybosom stymulowany aminoglikozydami, zamiast przerywać produkcję białka, odczytuje go jako kodon sensowny kodujący aminokwas i translacja jest kontynuowana, aż do osiągnięcia właściwego końca – prawidłowego kodonu STOP. Efekt można przyrównać do zagrania melodii z jedną fałszywą nutą – wszyscy bez problemu rozpoznajemy co to za piosenka, a na pojedynczy zgrzyt przymykamy oko. Podobnie dzieje się z białkiem – jest ono właściwej długości, a jeden błędny aminokwas w większości przypadków nie ma większego wpływu na jego funkcjonalność. W takim razie jak rybosom rozpoznaje, który kodon STOP jest przedwczesny, a który to ten prawidłowy, kończący sekwencję aminokwasów w białku? Ogromną rolę odgrywa tu sekwencja otaczająca kodon STOP – konkretne literki kodu genetycznego (nukleotydy) otaczające prawidłowy kodon STOP stymulują rybosom do przerwania pracy. Dzięki temu nie dochodzi do masowej produkcji nadmiernie wydłużonych białek.
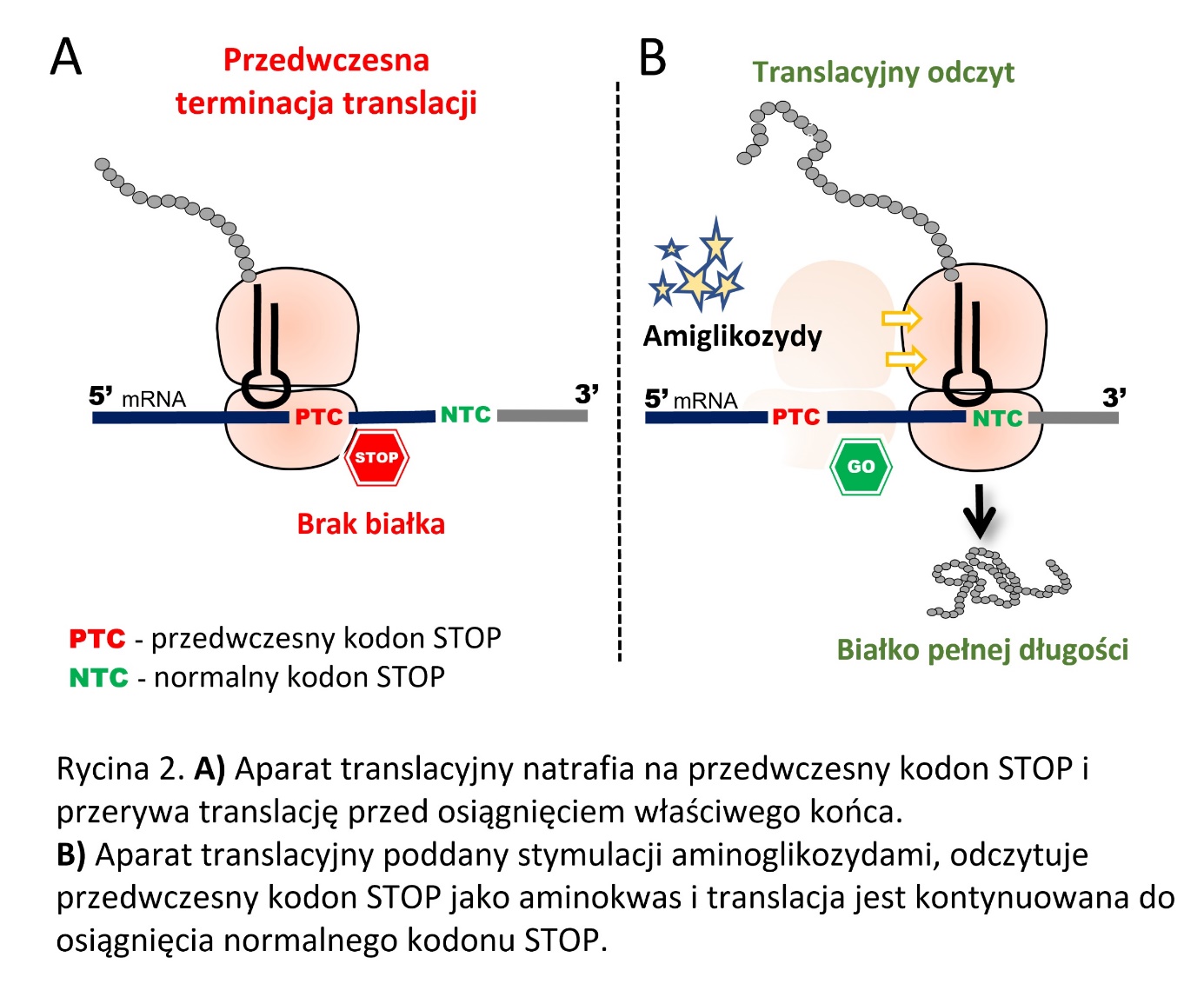
Stymulację rybosomów aminoglikozydami badano w modelach kilkudziesięciu różnych chorób genetycznych, poczynając od badań na sztucznych modelach badawczych, przez myszy z konkretnymi mutacjami, na badaniach klinicznych na ludziach kończąc. Niestety, nie ma róży bez kolców – o ile w sztucznych warunkach możliwe było przywrócenie produkcji ok. 25% funkcjonalnego białka, tak w przypadku większości pacjentów efekt terapeutyczny był znikomy. Wyjątkiem jest tu pęcherzowe oddzielanie się naskórka, gdzie w jednym z badań klinicznych udało się przywrócić praktycznie 100% ekspresji kolagenu VII, znacznie redukujące symptomy choroby u pacjenta.
Jedną z przyczyn trudności w stosowaniu antybiotyków aminoglikozydowych jest ich toksyczność – stężenia skutecznie stymulujące odczyt przedwczesnych kodonów STOP są zbyt toksyczne, by podawać je chorym. Obecnie naukowcy skupiają się na opracowaniu syntetycznych pochodnych aminoglikozydów, o niższej toksyczności i wyższej efektywności. Przykładem może być Ataluren, zarejestrowany na terenie Unii Europejskiej w leczeniu dystrofii mięśniowej Duchenna. Inne starania skupiają się na badaniu już istniejących leków pod kątem ich zdolności do stymulacji odczytu kodonów STOP. Takie zjawisko udało się wykryć w przypadku ziołowego leku przeciwzapalnego Escyny, antyalergicznego i przeciwzapalnego Amleksanoksu czy makrolidów – innej szerokiej grupy antybiotyków.
Co ciekawe, zjawisko translacyjnego odczytu kodonów STOP odkryto również w komórkach ludzkich niepoddanych stymulacji aminoglikozydami. Przykładem mogą być geny LDHB i MDH1, które w czasie translacji generują dwie formy białka- dłuższą i krótszą. W zależności od długości, białka te trafiają do różnych lokalizacji w komórce. Innym interesującym przykładem są genomy wirusów. W ich przypadku zjawisko translacyjnego odczytu kodonów STOP służy jak najbardziej efektywnemu wykorzystaniu kodu genetycznego. Dzięki temu jeden gen może kodować wiele różnych białek, oddzielonych od siebie kodonami STOP. Taka minimalizacja długości pozwala wirusom na szybszą replikację, minimalizuje ilość zużywanych zasobów i umożliwia infekcję większej ilości komórek.
Odkrycie skutecznych alternatyw dla aminoglikozydów lub zmodyfikowanie istniejących obecnie związków chemicznych być może otworzy drogę dla terapii będących znacznie tańszym i mniej ingerującym w organizm odpowiednikiem terapii genowej. Niestety, nadal pozostaje wiele wyzwań do pokonania, między innymi określenie metody doboru pacjentów, mogących odnieść korzyść z takich terapii – tylko niektóre mutacje będą podatne na stymulację. Dodatkowo, zanim takie terapie staną się powszechnie dostępne, niezbędne będzie przeprowadzenie szeroko zakrojonych prób klinicznych, potwierdzający bezpieczeństwo i skuteczność danego leku.
Dodatkowa literatura:
Dąbrowski M, Bukowy-Bieryłło Z, Ziętkiewicz E; “Advances in therapeutic use
of a drug-stimulated translational readthrough of premature termination codons”
Molecular Medicine 24, 25 (2018).
Woodley DT, Cogan J, Hou Y, Lyu C, Marinkovich MP, Keene D, Chen M.
Gentamicin induces functional type VII collagen in recessive dystrophic
epidermolysis bullosa patients. J Clin Invest 2017; 127.
Nagel-Wolfrum K, Möller F, Penner I, Baasov T, Wolfrum U. Targeting Nonsense
Mutations in Diseases with Translational Read-Through-Inducing Drugs (TRIDs).
BioDrugs Clin Immunother Biopharm Gene Ther 2016; 30:49–74.
Dąbrowski M, Bukowy-Bieryłło Z, Ziętkiewicz E; “Translational readthrough
potential of natural termination codons in eucaryotes – The impact of RNA sequence”.
RNA Biology 12.9 (2015): 950-958.
Lee H-LR, Dougherty JP. Pharmaceutical therapies to recode nonsense mutations in
inherited diseases. Pharmacol Ther 2012; 136:227–66.
Nudelman I, Rebibo-Sabbah A, Shallom-Shezifi D, Hainrichson M, Stahl I, Ben-
Yosef T, Baasov T. Redesign of aminoglycosides for treatment of human genetic
diseases caused by premature stop mutations. Bioorg Med Chem Lett 2006;
16:6310–5.