Czy dostępny chemioterapeutyk może pomóc jednemu pacjentowi, a dla drugiego okazać się nieskuteczny? W przypadku pana Henryka, zdiagnozowanego z nieoperacyjnym rakiem żołądka, leczenie nie przynosiło oczekiwanych korzyści. Niedługo po rozpoczęciu zalecanej terapii, guz zamiast zmniejszyć swoją objętość, zaczął się rozrastać. W wyniku progresji choroby, pacjent zmarł.
Niemal wszyscy znamy taki scenariusz, czy to z własnego doświadczenia, czy też prasy. Czy można przewidzieć sytuację, w której chory nie odpowiada na leczenie? W ostatnich latach rozwija się nowa gałąź nauki, która zdecydowanie nas do tego przybliża – farmakogenetyka. I wcale nie jest to melodia przyszłości, bo takie badania możemy już przeprowadzać także w Polsce.
Źródło: https://isogg.org/wiki/File:SNP_diagram.png#filelinks
Późniejsze badania genetyczne wykazały, że wspomniany wyżej pacjent posiadał w DNA komórek guza zmieniony wariant jednego nukleotydu w genie TP53 . Taką małą zmianę w genomie genetycy nazywają SNPem (wym. snipem, ang. single nucleotide polymorphism). SNP polega na zamianie jednego nukleotydu na inny, co można obrazowo porównać do omyłkowego wciśnięcia na klawiaturze innej litery niż zamierzona. Tak jak w przypadku pisania długiego tekstu, często zdarzają się literówki, tak i SNPy występują powszechnie w naszym genomie. Czynnikiem sprawczym w tym przypadku są enzymy, które „przepisując” DNA, w celu jego powielenia, popełniają te drobne błędy. Z reguły nie niosą ze sobą żadnych konsekwencji ze względu na fakt, że nasz genom składa się z 3.2 miliarda nukleotydów, a prawie 99% z nich nie koduje informacji o budowie białka. Jednak część takich zmian może mieć wpływ na funkcjonowanie organizmu człowieka, na przykład determinując odpowiedź na określone leki. Tak też było w przytoczonym wyżej przypadku pana Henryka, ponieważ znaleziony u pacjenta wariant genetyczny odpowiadał za zmienioną odpowiedź na chemioterapeutyki wykorzystywane w terapii raka żołądka: konkretniej, na odpowiedź pacjenta na fluorouracyl i oksaliplatynę.
60 lat wstecz
Gałąź nauki, która zajmuje się powiązaniem stanu genomu z odpowiedzią na leki wyewoluowała dzięki genetykom klinicznym w późnych latach 50-tych ubiegłego wieku. Za ojca farmakogenetyki uznaje się Arno Motulsky’ego, który w 1957 opublikował artykuł traktujący o powiązaniu działań niepożądanych leków z uszkodzeniem aktywności specyficznych enzymów. Samo pojęcie farmakogenetyka istnieje w literaturze od 1959 roku, a wprowadził je współpracownik Motulsky’ego, Friedrich Vogel. Do rozwoju tej dziedziny przyczynił się m.in. zakończony sukcesem w 2003 roku Projekt Poznania Genomu Człowieka (ang. Human Genome Project), mający na celu rozszyfrowanie ludzkiego genomu, a także ewolucja narzędzi bioinformatycznych i publicznie dostępnych baz danych. Obecnie farmakogenetyka bada wpływ informacji zawartych w genomie na reakcję organizmu na podanie określonego leku, nie tylko w kontekście jego skuteczności, ale także bezpieczeństwa.
Od SNPa do terapii
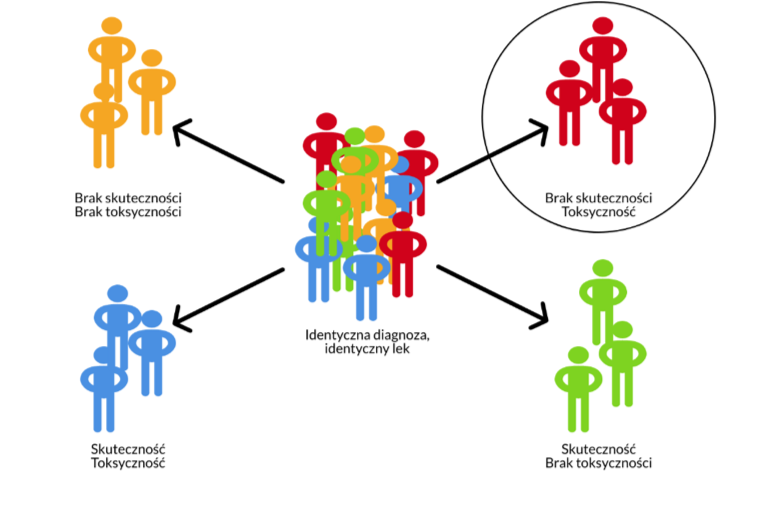
Wróćmy do opisanej na początku historii pacjenta chorującego na raka żołądka. Poddał się on chemioterapii z wykorzystaniem leków, które z jednej strony niszczą komórki nowotworowe, ale z drugiej strony wykazują toksyczne działanie również w stosunku do komórek zdrowych. Jakie są możliwości reakcji organizmu pacjenta po podaniu leku? Najlepiej ilustruje to prosta rycina:
Rysunek wykonano dzięki platformie https://piktochart.com/.
Powyższy rysunek jest poglądowy – rzadko kiedy lekarz jest w stanie precyzyjnie określić dla danego chorego, jaka jest dokładna skuteczność wybranej metody terapeutycznej oraz ryzyko wystąpienia działań niepożądanych konkretnego leku. Nie da się tego zrobić bez drogich testów, które nie zawsze przynoszą jednoznaczną odpowiedź. Wykonanie badań farmakogenetycznych daje jednak niekiedy możliwość przewidzenia negatywnych reakcji organizmu po ewentualnym podaniu leku i wyboru alternatywnego leczenia, o ile jest dostępne. Nie znaczy to jednak, że bez wykonania testów genetycznych, pacjent powinien odmówić ryzykownego leczenia – czasem trzeba działać szybko, a brak farmakoterapii może być bardziej niebezpieczny niż możliwe efekty uboczne.
Istnieje szereg sytuacji, w których wiedza o metabolizmie leków jest niezwykle istotna i może wpłynąć na wybór zastosowanej terapii. Przykładem jest abakawir, który jest przepisywany osobom zakażonym wirusem HIV. Około 10% populacji kaukaskiej posiada zmienioną wersję genu HLA-B . Kodowane przez gen białko pełni ważną rolę w układzie immunologicznym. Obecność określonego wariantu w tym genie daje 50% szans na wystąpienie ciężkiej reakcji nadwrażliwości po podaniu abakawiru, prowadzącej nawet do śmierci.
Natomiast wśród leków przeciwnowotworowych przykładem mogą być tiopuryny wykorzystywane w leczeniu białaczek. Chory, który nie ma funkcjonalnej kopii genu TPMT, nie jest w stanie w pełni metabolizować tiopuryn. Prowadzi to do nagromadzenia się toksycznych metabolitów w komórkach oraz znacznego osłabienia organizmu, skutkującego przerwaniem chemioterapii. W konsekwencji może dojść do nawrotu nowotworu lub skrócenia czasu wolnego od choroby.
| LEK | SNP | GEN | DZIAŁANIE | ŹRÓDŁO |
|---|---|---|---|---|
| Warfaryna | rs1057910 | CYP2C9 | Warfaryna jest najbardziej powszechnym lekiem przeciwzakrzepowym na świecie. W zależności od tego, jaki wariant genu odpowiedzialnego za metabolizm warfaryny (CYP2C9) posiada pacjent, powinno się ustalać odpowiednią dla niego dawkę. Może to zapobiec krwotokom. | link |
| Aripiprazol | rs48969 | MC4R | Aripiprazol jest lekiem stosowanym w psychiatrii w przypadku takich schorzeń jak np. schizofrenia. W zależności od wariantu genu MC4R, pacjent może się cechować zwiększonym/zmniejszonym ryzkiem wystąpienia przyrostu masy ciała i hipertriglicerydemii. | link |
| Cisplatyna | rs2228001 | XPC | Cisplatyna jest powszechnie używanym lekiem przeciwnowotworowym. Zmiany w genie XPC mogą informować o zwiększonym ryzyku wystąpienia u pacjenta takich działań niepożądanych takich jak utrata słuchu i neutropenia[2]. | link |
| Kodeina | – | CYP2D6 | Kodeina jest lekiem, który działa przeciwbólowo, a w małych dawkach przeciwkaszlowo. W zależności od wariantu genu CYP2D6 (nie używa się w tym przypadku numeru SNPa, dla genu CYP2D6 występuje osobna nomenklatura wariantów), pacjent może się cechować zwiększonym/zmniejszonym ryzykiem wystąpienia depresji oddechowej[3]. | link |
| Karbamazepina | HLA-B*15:02:01 | HLA-B | Karbamazepina jest lekiem, który stosuje się głównie w leczeniu padaczki i choroby afektywnej dwubiegunowej. W zależności od wariantu genu HLA-B u pacjenta może wystąpić zwiększone ryzyko wystąpienia toksycznej nekrolizy naskórka. | link |
Tab. 1 Przykłady leków, których działania niepożądane lub szybkość ich metabolizowania jest ściśle związana z wariantami genetycznymi.
Wyzwania (nie) do przeskoczenia
W Polsce nie istnieją standardy wykonywania testów farmakogenetycznych. Badania można zlecić prywatnie w kilku ośrodkach w kraju. Najczęściej ograniczają się one do sekwencjonowania kilku – kilkudziesięciu genów odpowiedzialnych za metabolizm różnych leków. Warto jednak zaznaczyć, że takie testy nie są antidotum na wszelkie efekty uboczne leczenia i nie każde działanie niepożądane jest możliwe do wykrycia za pomocą sekwencjonowania genów. To, jak organizm reaguje na lek, jest złożonym procesem, na który składają się także czynniki środowiskowe, takie jak dieta i styl życia.
Poważnym ograniczeniem jest też fakt, że przed wprowadzeniem testów farmakogenetycznych jako standardu, potrzebne są niezbite dowody potwierdzające ich wiarygodność. W przypadku medycyny jest to skomplikowany i długotrały proces, ponieważ wymaga randomizowanych badań klinicznych. Te z kolei pochłaniają duże zasoby finansowe. Sponsorami badań są z reguły koncerny farmaceutyczne, które chcą wprowadzić na rynek swój lek. Czy z punktu widzenia ogromnej firmy badania farmakogenetyczne są zawsze korzystne? Wyobraźmy sobie sytuację, w której na rynku europejskim od 10 lat istnieje lek na określone schorzenie, który jest darzony ogólnym zaufaniem wśród lekarzy i społeczeństwa. Testy genetyczne wykazują jednak, że 15% Europejczyków nie metabolizuje go w oczekiwany sposób. Sprzedaż automatycznie spada, firma traci pieniądze – niezbyt korzystny scenariusz, prawda? Na szczęście wiele koncernów przy wdrażaniu nowych leków kieruje się podejściem, które zakłada, że jak najszybsze wykrycie grupy osób źle odpowiadającej na lek jest korzystne i dla pacjenta, i dla marki. Z tego względu znajdziemy też firmy, które wspierają farmakogenetykę.
Mierzalne korzyści
Według artykułu Liam’a Drew z 2016 roku opublikowanego w Nature, dane o zmianach już w około 20 genach zapewniają wiarygodną informację o reakcji organizmu na 80-100 leków. Stanowi to 7% farmaceutyków dopuszczonych do obrotu w Stanach Zjednoczonych przez Food and Drug Administration. Są to między innymi: opioidy, leki stosowane w psychiatrii, leki przeciwnowotworowe, antykoagulanty oraz statyny. Wstarczyłoby wykonać takie badanie przed podaniem leku z wyżej wymienionych grup – otrzymany wynik w połączeniu z informacjami zebranymi w wywiadzie środowiskowym i danymi klinicznymi pozwoliłby na bardziej efektywną farmakoterapię.
Testy farmakogenetyczne natomiast najczęściej wykonuje się, kiedy pacjent nie odpowiada na leczenie lub odpowiada na nie źle. W polskim szpitalu istnieje standard, którego lekarz musi się ściśle trzymać, bo obliguje go do tego prawo. Kiedy jeden lek nie działa, to podaje kolejny z listy zarejestrowanych i dostępnych. Tak jest niemalże na całym świecie i niewiele jest miejsc, gdzie leczenie przebiega według innych schematów, a celem takiej standaryzacji jest dobro pacjenta.
Odkładając na bok oczywiste korzyści dla chorego, dane farmakogenetyczne są w stanie przyczynić się też do oszczędności w systemie opieki zdrowotnej. Pacjent, dla którego terapia dobrana jest indywidualnie, przebywa w szpitalu krócej, szybciej dochodzi do pełni sił. Przyjmuje też mniejszą ilość leków, ponieważ podejście to eliminuje od razu te nietrafione, tym samym szybciej zdrowieje i wraca do pracy. Dotyczy to głównie leków, w przypadku których zalecana farmakoterapia znacznie przewyższa koszty badania genetycznego. Jeśli lek jest dostatecznie tani i jest tzw. lekiem pierwszego rzutu w przypadku danej choroby, realnie nie istnieje szansa refundacji takiego badania przed jego podaniem.
Niezatwierdzony standard?
Hipokrates nie bez powodu uważał, że „znacznie ważniejsze jest wiedzieć, co za osoba ma daną chorobę niż to, jaką chorobę ma dana osoba”. Dzięki dostępnym na dzień dzisiejszy narzędziom, współczesny lekarz jest w stanie otrzymać zestaw wartościowych informacji, dotyczących predyspozycji pacjenta do określonego leczenia. Biorąc pod uwagę korzyści dla chorego i oszczędności wynikające z personalizowanej terapii, wydaje się, że badania farmakogenetyczne powinny być standardem. Posiadając tak dużą wiedzę na ten temat, szkodą dla pacjenta byłoby jej praktycznie nie wykorzystać i nie wdrażać w system opieki zdrowotnej. W ciągu najbliższych 10 lat okaże się, czy zalety będą w stanie przewyższyć współtowarzyszące obawy i czy wejdą do codziennej praktyki klinicznej.
Imię pacjenta zostało zmienione, historia jest prawdziwa.







